Paul Goodwin, diretor de ciências da GE Healthcare Life Sciences, discute como a biofabricação 3D pode melhorar a precisão da saúde no futuro. 25 September 2018
Tradução de Ana Luiza Millás, do original : https://www.epmmagazine.com/pharmaceutical-industry-insights/three-challenges-one-big-opportunity-the-future-of-3d-biopri/
Somente nos EUA, há anualmente mais de 120.000 pessoas aguardando por órgãos nas filas de transplantes e são menos de 15.000 doadores. E se pudéssemos fabricar órgãos a partir de células e, essencialmente, resolver essa escassez sem qualquer doador necessário? Talvez ambicioso. Mas, quem sabe possível.
Embora a bioimpressão 3D possa parecer um sonho, ela pode ter implicações positivas no sistema de saúde. Esses três obstáculos – Materiais, Vascularização e Aprovação Regulatória – são os maiores desafios a serem superados antes que a bioimpressão 3D se torne uma realidade.
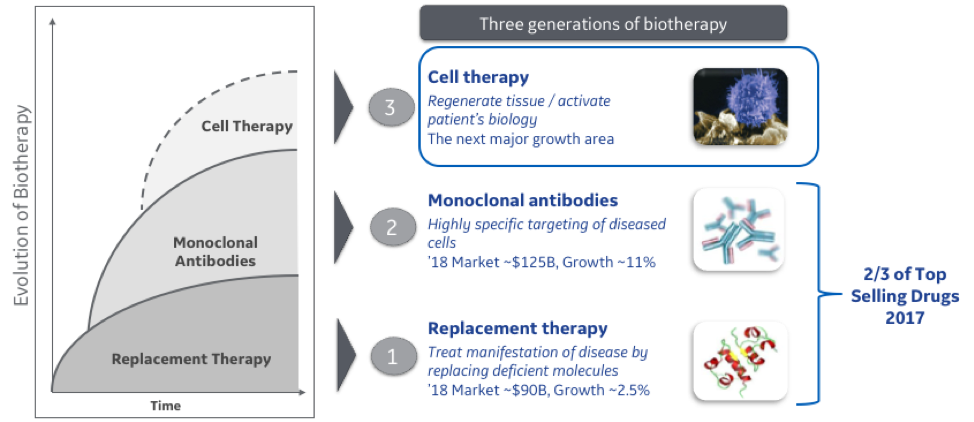
A evolução da terapia biomédica e da medicina de precisão
A primeira terapia biomédica surgiu com as proteínas recombinantes, que são sintetizadas e administradas a pacientes com insuficiência na sua produção. Em 1982, a Genentech transformou o tratamento de pacientes com diabetes Tipo 1 e Tipo 2, quando trouxe ao mercado a primeira insulina humana. Uma série de empresas de biotecnologia seguiram o mesmo exemplo, criando e trazendo novas terapias. Hoje, sete dos medicamentos mais vendidos são proteínas recombinantes usadas para tratar doenças do hospedeiro, desde artrite reumatóide até diabetes e câncer.
Em 1986, o primeiro tratamento terapêutico baseado em anticorpos foi criado usando um anticorpo monoclonal de camundongo contra o CD3 humano para prevenir a rejeição do transplante renal (muromonab-CD3). No entanto, o uso deste terapêutico foi limitado a alguns casos, porque o uso a longo prazo causou uma série de problemas devido a interações de anticorpos entre humanos e camundongos. Ao longo dos anos, uma série de melhorias foram feitas para manipular geneticamente anticorpos terapêuticos para serem mais parecidos com seres humanos e hoje, cinco desses sete são os principais produtos farmacêuticos de proteína com mais de 100 atualmente no mercado e centenas de outros em desenvolvimento.
Após o sucesso dos mAbs, a indústria deu mais um passo rumo à medicina verdadeiramente precisa: usando células como agentes terapêuticos. No cenário mais comum, as células imunológicas são removidas do paciente e geneticamente modificadas para reconhecer as células cancerosas no paciente. As células imunes modificadas são então multiplicadas para fora do paciente e, em seguida, reintroduzidas no paciente, onde agora reconhecem o câncer do paciente e montam uma resposta. Essa tecnologia, chamada terapia de células T, é a base de terapias recentemente aprovadas para tratar cânceres sanguíneos (linfomas e leucemias) que são resistentes a terapias convencionais. Com as recentes aprovações das duas primeiras terapias com células T, a indústria de biotecnologia está apenas começando a aproveitar o potencial clínico desses medicamentos incrivelmente personalizados.
No entanto, a terapia com células T é apenas o começo de nossa jornada em direção à saúde de precisão. Se tivermos feito esses tipos de tratamentos, teremos um enorme impacto paciente, mas perderemos a maior parte da oportunidade na área da saúde.
A medicina de precisão do futuro será a impressão 3D de órgãos?
O número de pessoas que esperam por transplantes de órgãos está crescendo três vezes mais rápido que o número de doadores. Os pacientes que não recebem transplantes dentro de seis meses do diagnóstico provavelmente não receberão um e possivelmente morrerão como resultado de falência de órgãos. Mesmo aqueles pacientes que recebem órgãos doados geralmente enfrentam uma vida inteira de terapia imunossupressora e doenças iatrogênicas associadas. Essa necessidade premente representa um tremendo fardo para o sistema de saúde, já que os pacientes que aguardam órgãos consomem uma parcela desproporcionalmente grande dos gastos com saúde (diálise, insuficiência cardíaca crônica, etc.). Além dos grandes órgãos vitais, há a necessidade de tecidos e órgãos menos “sexy” na ortopedia (cartilagem do joelho e da coluna vertebral), urologia (ureteres e bexigas), cirurgia reconstrutiva (defeitos cranianos, reparo mandibular, etc.), obstetrícia e ginecologia (reconstruções de ovários) e outras áreas que contribuem para dor significativa, sofrimento e bilhões de dólares em perdas econômicas.
Sempre que há uma diferença entre oferta e demanda, novas tecnologias e modelos de negócios são introduzidos para atender à demanda. Assim, surge a idéia de manufatura aditiva ou simplesmente bioimpressão 3D. A manufatura aditiva de peças mecânicas ou peças inteiras de equipamentos causou um tremendo impacto nos custos, recursos, tempo e redução de desperdício nas indústrias manufatureiras tradicionais. Então, ficamos com a questão de saber se podemos trocar a resina por células e imprimir órgãos para produzir o mesmo efeito para o setor de saúde. Estudos de marketing preveem que o tamanho atual do mercado de biofabricação é de aproximadamente US $ 350 milhões, quase que inteiramente para pesquisa e mercados aplicados. Em 2021, estima-se que o mercado se expandirá para US $ 1,8, com US $ 1,2 bilhão sendo aplicado em aplicações clínicas. [BE (H1)
A indústria pode criar uma infra-estrutura para imprimir tecidos e órgãos em 3D regulamentados para atender às necessidades clínicas da Medicina Regenerativa?
Isso exigirá conhecimento da manufatura aditiva tradicional, uma infra-estrutura digital para unir os fluxos de trabalho, desde a terceirização até o gerenciamento do paciente e o controle de qualidade do processo. E nós vamos ter que resolver esses três grandes desafios:
Materiais
Na manufatura aditiva, é importante controlar as propriedades físicas da peça que está sendo fabricada. A forma, força, flexibilidade, resistência química, acabamento superficial, etc, devem ser rigidamente controlados. Na impressão de peças mecânicas, essas propriedades são controladas pela escolha da tecnologia de impressão e dos materiais de impressão. Na bioimpressão não é tão diferente. Não podemos simplesmente começar a imprimir células; essas células devem ser impressas em uma matriz de material que sirva de suporte, dê forma e possua as propriedades mecânicas dos tecidos e órgãos desejados. E não podemos nos concentrar apenas em fornecer as propriedades físicas; estes materiais também devem ser quimicamente compatíveis com as células durante a impressão e com o paciente quando implantado.
Mesmo a maneira pela qual depositamos os materiais – a tecnologia ou mecanismo de impressão – deve ser cuidadosamente selecionada. Os materiais/insumos utilizados nas bioimpressoras são referidos como bioinks ou biotintas. Uma abordagem é tentar usar uma única biotinta para tudo que você queira imprimir, mas a biologia nos ensinou que o espaço entre as células é crítico para a biologia das células. Precisamos de uma vasta gama de materiais para apoiar, manter e regular adequadamente as células dentro dos tecidos e órgãos. Pense nisso como o equivalente a comparar um desenho a lápis de M. C. Escher às pinturas elaboradas e intrincadamente coloridas de Jean-Claude Monet. A biologia prefere Monet. Há mais de um ano trabalhamos com o Dr. Ramille Shah na Northwestern University. A Ramille desenvolveu mais de 300 “cores” diferentes de biotintas e PINTURAS para a construção de tecidos biológicos. Um dos materiais de grande interesse é o osso hiperelástico. Esta PINTURA é mais de 90% de hidroxiapatita (o mineral nos ossos), sendo o restante aglutinantes, elastômeros e agentes que ajudam a tornar a PAINT imprimível. Uma vez impressos, a maioria dos materiais adicionados evapora ou pode ser lavada, deixando um material semelhante a um osso que pode ser flexível como papel de seda ou tão rígido quanto um osso sólido.
Vascularização
Não é suficiente criar um ambiente físico e químico para as células. Você também deve criar um ambiente biológico que suporte as células. Um dos desafios mais significativos a esse respeito é criar um suprimento de sangue para nutrir as células, fornecer oxigênio e transportar resíduos. No corpo, qualquer célula que esteja mais do que a largura de um cabelo longe de um suprimento de sangue sofrerá. Além disso, a vascularização natural faz um trabalho incrível ao fornecer perfusões uniformes (fornecimento igual de nutrição e oxigênio no espaço), além de manter baixa resistência ao fluxo. A maioria das tentativas humanas de recriar um leito vascular viável não fornece tanto perfusão quanto baixa resistência ao fluxo. Se observarmos os tecidos nativos, veremos que a vasculatura não é engenhosamente projetada, mas se assemelha a uma rede semi-caótica de vasos. Temos trabalhado com Jay Hoying na Advanced Solutions Life Sciences (ASLS), que se deparou com uma maneira de criar essas vasculaturas mais nativas. Anos atrás, Jay estava trabalhando como um jovem investigador estudando microvasculatura. Para seu modelo experimental, ele usava gordura abdominal de camundongos. Por sorte, ele descobriu que pedaços rasgados de microvasculatura desenvolverão espontaneamente novos vasos (angiogênese) e que esses novos vasos se auto-montarão em um leito vascular que recria a estrutura nativa semi-caótica. Quando ele colocou esses leitos com tecidos diferentes (coração, fígado, rim, neural), eles criariam espontaneamente leitos vasculares semelhantes ao que você encontraria nesses tecidos do corpo. Estamos agora trabalhando com o ASLS para usar instrumentos de imagem celular para criar uma estação de trabalho ágil totalmente automatizada para impressão, verificação (física, química e biológica) e maturação dos tecidos vascularizados.
Aprovação regulatória
Um dos maiores desafios em torno da bioimpressão é a regulamentação. O FDA normalmente regula produtos e dispositivos em que o mesmo design é usado para tratar muitas pessoas. No caso de um biológico, um lote de fabricação pode tratar de milhares a milhões de pessoas. O processo regulatório assegura que o produto é seguro e eficaz e que cada um deles é exatamente igual. Tal como acontece com outros “medicamentos de precisão”, como as terapias com células T, a principal vantagem do bioimpressão é que cada produto é adaptado para o paciente, incluindo o uso de células do paciente para criar o tecido ou órgão. A desvantagem, é claro, é que isso representa um desafio significativo para os reguladores, pois as células são ideais para cada paciente individualmente, mas também significa que cada tratamento é único. A FDA tem enfrentado a necessidade de criar novas formas de regular o processo e não apenas o produto. No caso das terapias com células T autólogas, as aprovações recentes abriram caminho para os reguladores criarem diretrizes para a fabricação de tecidos e órgãos sob medida e autólogos. O FDA trabalha em estreita colaboração com parceiros da indústria, incluindo alguns líderes da GEHC, para criar diretrizes para dispositivos sob medida criados usando manufatura aditiva.
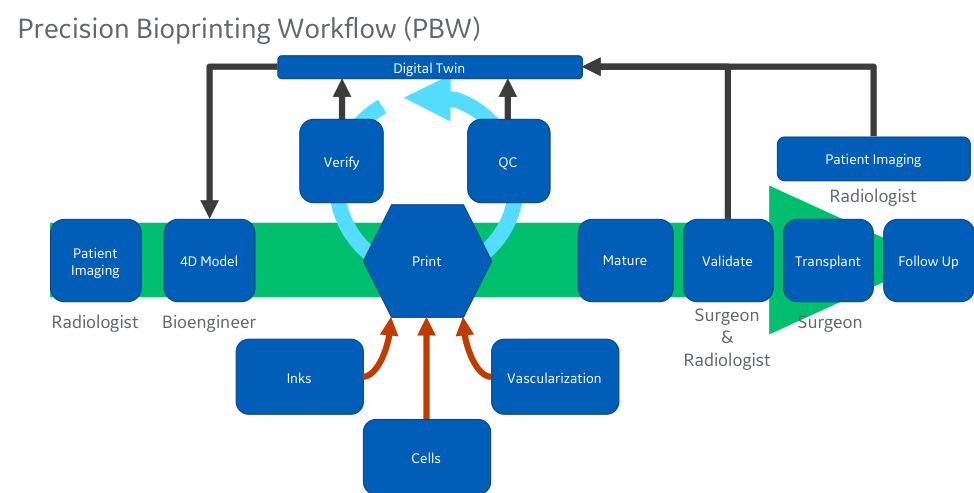
Comece com o fruto de baixo-relevo: Trazendo Bioprinting 3D para a vida
A Medicina regenerativa não é nova. Bioengenheiros e clínicos têm trabalhado neste campo há décadas, mas agora temos algo diferente: pela primeira vez na história da humanidade, podemos aproveitar a convergência da biologia, da impressão 3D, da análise digital e, talvez mais importante de tudo, de um ambiente regulatório que está preparado para considerar as terapias personalizadas, considerando cada paciente. Há esforços significativos acontecendo na academia, nas indústrias biofarmacêuticas e de dispositivos médicos. Algumas empresas estão se concentrando nas necessidades de curto prazo em Pesquisa e Mercados Aplicados e abandonando o mercado clínico, pelo menos, por enquanto.
De fato, ainda estamos há alguns anos de fornecer um sistema de órgãos totalmente funcional em um ambiente clínico. Rins, fígados, pulmões, corações e sistemas neurológicos terão que esperar por mais desenvolvimento. Eu diria que existem vários tecidos “mais fáceis” que são mais de curto prazo e que há muito a aprender começando por eles. Afinal de contas, se acreditamos que poderemos entregar órgãos totalmente funcionais, teremos que parar para elaborar os modelos de negócios, cadeia de fornecimento, questões regulatórias e uma série de outros desafios que terão de ser enfrentados antes da entrega terapêutica.
Por exemplo:
Estima-se que 214.000 procedimentos craniofaciais são realizados nos EUA ao ano. Muitos destes requerem enxertos de osso vascularizado saudável. Hoje, esse osso vem de outros locais do mesmo paciente (fíbula, quadril etc.), o que torna a cirurgia mais longa, mais cara e muito mais difícil de se recuperar. Podemos criar osso vascularizado e saudável por meio de manufatura aditiva sem ter que sacrificar outros ossos no paciente?
Mais de 50% dos adultos americanos desenvolverão artrite nos joelhos causada pelo uso excessivo da cartilagem que protege e lubrifica a articulação do joelho (o menisco). Isso leva a mais de 600.000 implantes de joelho anualmente nos EUA, ao custo de mais de US $ 1,2 bilhão. Podemos reduzir esse custo simplesmente substituindo o menisco antes que o osso seja permanentemente danificado?
O diabetes tipo 1 é uma doença auto-imune que leva à perda das células das ilhotas no pâncreas. Essas células produzem insulina para regular a glicose no corpo. Sem as células de ilhéus, não é possível controlar a glicose, o que leva a doenças cardiovasculares, cegueira e perda de membros. Podemos imprimir um pâncreas das próprias células do paciente e construir proteções que irão manter a autoimunidade sob controle? Isso não só melhoraria a qualidade de vida dos 1,25 milhão de pacientes que sofrem dessa doença, mas também poderia aliviar uma carga anual de US $ 10,6 bilhões (somente nos EUA).
Pode ser que leve uma década ou mais antes de conseguirmos imprimir órgãos vitais de substituição clinicamente viáveis, como os rins, mas, com a união de esforços, podemos chegar lá, deixando os tecidos em mais curto prazo trilhar o caminho.